Chemisch veränderter Hoffnungsträger
ETH-Forscher haben Phagen so verändert, dass sie länger im Blut zirkulieren und ihre Infektiosität gegenüber Bakterien trotzdem nicht verlieren. Das weckt Hoffnung auf wirksames Heilverfahren gegen resistente Krankheitserreger.
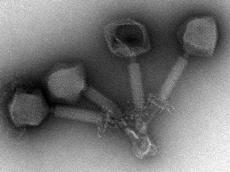
Bakteriophagen, kurz auch Phagen genannt, könnten in naher Zukunft wichtig werden. Diese winzigen Organismen sind die Feinde der Feinde des Menschen. Sprich: Sie vernichten zielgerichtet und spezifisch Bakterien, darunter auch solche, die dem Menschen schwer zu schaffen machen, wie etwa Antibiotika resistente Spitalkeime. Doch nach wie vor tun sich westliche Mediziner und Pharmafirmen schwer mit dem Gedanken, Phagen zur Therapie von schweren Infektionskrankheiten einzusetzen.
Penicillin verdrängte Phagentherapie
Dies habe unter anderem damit zu tun, dass die Phagentherapie als alter Hut abgetan werde, sagt Martin Loessner, Professor für Lebensmittelmikrobiologie am Institut für Lebensmittel- und Ernährungswissenschaften der ETH Zürich. Entdeckt wurden die Phagen als natürliche Feinde von Bakterien in den Jahren nach dem ersten Weltkrieg, und in östlichen Ländern hat sich das Wissen bis in die heutige Zeit erhalten. Nicht so im Westen, wo nach der Entdeckung der ersten Antibiotika (Streptomycin und Penicillin) in der 1940er Jahren die Bakteriophagen vergessen wurden. Langsam setzt sich aber auch im Westen die Einsicht durch, dass diese eine Alternative oder Ergänzung zu Antibiotika sein können.
Auch Martin Loessner ist von Phagen überzeugt. Im Lebensmittelbereich sind diese Virenpartikel als Zusatz zugelassen, weil sie die Bakterienfracht in Nahrungsmitteln, etwa die gefürchteten Listerien, dezimieren und damit den Menschen zu gesünderer Nahrung verhelfen.
Phagen maskieren
Will man Phagen einsetzen, um Infektionserreger im Körper abzutöten, sind noch einige Hindernisse zu überwinden. Die Immunabwehr eliminiert die Partikel rasch und effizient aus dem Blut und entwickelt obendrein ein Gedächtnis gegen sie. Dadurch kann sich der Körper bei einer erneuten Phagenapplikation noch effektiver gegen die fremden „Eindringlinge“ schützen und sie eliminieren.
Soll eine Therapie aber nützen, müssen die Phagen länger im Körper bleiben. Die Forschungsgruppe von Martin Loessner hat deshalb einen Ansatz aus der Krebstherapie verwendet und Oberflächenproteine von zwei Phagen A511 und Felix-O1 – beide sind die natürlichen Feinde von Listerien bzw. Salmonellen - mit einem Polyethylen-Glykol (PEG) chemisch verändert. Dies soll die Phagen tarnen und sie dem Zugriff des Immunsystems entziehen.
Tarnung wirkt
Versuche mit mit Mäuseserum und Mäusen bestätigten, dass die chemische Tarnung von A5111 und Felix-O1 wirkte. Mit PEG modifizierte Phagen, insbesondere A511, verblieben länger im Blutstrom als die entsprechenden Wildtypen. Die Maskierung mit PEG bewirkte auch, dass T-Zellen weniger Immunbotenstoffe wie Interleukin-6 oder Interferon-Gamma freisetzen, um Fresszellen anzulocken, welche die Phagen vernichten können. Allerdings büssten die Virenpartikel wegen der chemischen Veränderung um bis zu 50 Prozent ihrer Infektiosität ein. Dies reicht aber offensichtlich noch immer, um die Bakterien zu beseitigen.
Dennoch bildeten die Testmäuse nach der ersten Verabreichung eine erworbene Immunität gegen die veränderten Phagen aus, und bei einer wiederholten Gabe von Phagen nach etwa 2 Wochen konnten sich die PEGylierten Phagen nicht länger halten als der Wildtyp. „Die PEGylierung bringt den veränderten Phagen bei der ersten Verabreichung ein Vorteil gegenüber dem Wildtyp, kann aber die Immunisierung nicht verhindern“, sagt Loessner. Dennoch wertet er die Versuche als Erfolg. „Wir haben den Beweis, dass das Konzept richtig ist.“
Vielversprechender Ansatz
Der Forscher sieht denn auch in der chemischen Veränderung von Oberflächenproteinen der Phagen einen viel versprechenden Ansatz. Weitere Forschung sei jedoch nötig, um medizinisch interessante Phagen zu verändern, die gegen die gefürchteten Staphylokokken oder Pseudomonaden, eingesetzt werden können. Beide Bakterien sind gegen viele Antibiotika resistent geworden und sind besonders in Spitälern gefürchtet.
Literaturhinweis:
Kwang-Pyo Kim, Jeong-Dan Cha, Eun-Hye Jang, Jochen Klumpp, Steven
Hagens, Wolf-Dietrich Hardt, Kyung-Yeol Lee, Martin J. Loessner (2008): PEGylation of bacteriophages increases blood circulation time and reduces T-helper type 1 immune response; Microbial Biotechnology, early online publication.
doi:10.1111/j.1751-7915.2008.00028.x








LESERKOMMENTARE