Kleine Untereinheit mit grossem Einfluss
In der neuesten Ausgabe von «Science» beschreiben Nenad Ban, Professor für molekulare Strukturbiologie an der ETH, und sein Team, die erste komplette Struktur der 40S-Untereinheit des Ribosoms eines hoch entwickelten Organismus. Dies ist nicht nur für Biologen ein Grund zur Freude.
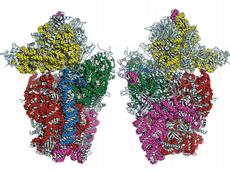
Proteine sind die Bausteine des Lebens. Ohne ihre ständige Produktion kann keine aktive Zelle überleben. Die Proteinherstellung ist deshalb ein zentraler biochemischer Prozess lebender Organismen. Dabei übersetzen verschiedene Enzyme die genetische Information, die auf der DNA gespeichert ist, in sogenannte Boten-RNA. Weitere komplexe Enzyme, die Ribosomen, lesen die Boten-RNA ab und setzen anhand dieser Vorlage Aminosäuren zu Proteinen zusammen. Ribosomen sind die eigentlichen Proteinproduzenten der Zellen und stehen deshalb bei Biologen im Fokus des Interesses.
Knifflige Kristalle
Die ersten Einblicke in die atomare Struktur von Ribosomen,
wurden schon vor zehn Jahren gewonnen. Ein Team um den Nobelpreisträger Tom
Steitz von der Universität Yale, zu dem auch Nenad Ban gehörte, beschrieb
damals einen Teil der Struktur eines bakteriellen Ribosoms. Ribosomen von höher
entwickelten Zellen sind jedoch grösser und komplexer als ihre bakteriellen
Gegenstücke, was die Strukturanalyse erschwert.
Sie bestehen aus zwei Untereinheiten, einer grossen 60S- und der kleinen 40S-Untereinheit. Der 40S-Untereinheit kommt bei der Proteinherstellung eine bedeutende Rolle zu: Sie erkennt zu Beginn der Proteinherstellung zuerst die Boten-RNA und bindet sie. Auch der Initiationsfaktor 1, ein Protein, das hilft, den korrekten Startpunkt für das Ablesen und Übersetzen der Boten-RNA zu finden, wird von der kleinen Untereinheit gebunden. Trotz intensiver Bemühungen widersetzte sie sich lange der Strukturanalyse, unter anderem, weil davon kaum brauchbare Kristalle herzustellen waren. Diese Kristalle sind aber nötig, um mit Hilfe von Röntgenstrahlen die Atompositionen im Kristallgitter bestimmen zu können.
Krankheitserreger torpedieren
Dem Team um Nenad Ban gelang es nun, dieses Hindernis zu
überwinden. Statt nur die Struktur der kleinen Untereinheit an sich zu
ermitteln, beschrieben die Forscher die Struktur der 40S-Untereinheit in Verbindung
mit dem Initiationsfaktor 1. Sie bestimmten dabei die Position aller 33
Proteine und der 1753 Nukleinsäure-Bausteine, aus denen die 40S-Untereinheit
zusammengesetzt ist. Mit dieser Forschungsarbeit schaffen die Wissenschaftler
eine wichtige Grundlage für medizinische Anwendungen: Die Kenntnis der Struktur
der 40S-Untereinheit könnte zur Entwicklung von neuen Medikamenten beitragen.
Viren programmieren die Ribosomen ihrer Wirtszelle so um, dass sie Proteine des Krankheitserregers herstellen. Medikamente, die solch umprogrammierte Ribosomen spezifisch an der Produktion von fremden Proteinen hindern könnten, würden die Verbreitung des Krankheitserregers verhindern. Auch für das Verständnis von Krankheiten, die mit einer gestörten Regulation und Initiation der Proteinherstellung in Verbindung gebracht werden, beispielsweise Krebs oder die Erbkrankheit Diamond-Blackfan-Anämie, bedeuten die neusten Erkenntnisse aus Bans Labor einen Fortschritt.
Die Ribosomen, mit denen ETH-Forscher auf diesen Forschungserfolg hinarbeiteten, stammen übrigens aus dem Modellorganismus Tetrahymena thermophila. Es handelt sich dabei um einen Einzeller, der schon im Zusammenhang mit anderen wissenschaftlichen Erfolgen, beispielsweise der Entdeckung von Telomeren, Berühmtheit erlangte.
Synergien nutzen
Erst nach vielen Jahren experimenteller Analysen gelang es Bans Team, Kristalle von 40S herzustellen, aus denen mittels Röntgen-Kristallographie die atomare Struktur hergeleitet werden konnte. Die ETH-Forscher profitierten während dieser Zeit von der Unterstützung des Nationalen Forschungsschwerpunkts Strukturbiologie des Schweizerischen Nationalfonds und des Europäischen Forschungsrats. Zudem konnten sie die Synchrotron-Lichtquelle an der Swiss Light Source Synchrotron (SLS) am Paul Scherrer Institut in Villigen nutzen, was massgeblich zum Forschungserfolg beigetragen hat. Mit weiteren strukturbasierten Experimenten und kristallographischen Studien will Nenad Ban in Zukunft Vorgänge aufklären, an denen die kleine Untereinheit des eukaryotischen Ribosoms beteiligt ist.
Literaturhinweis
Rabl J.,
Leibundgut M., Ataide S. F., Haag A., Ban N. Crystal Structure of the
Eukaryotic 40S Ribosomal Subunit in Complex with Initiation Factor 1. Science;
Feb. 2011, Vol. 331, no. 6018 pp. 730-736. doi:10.1126/science.1198308








LESERKOMMENTARE