Dem Erreger des Rinderwahnsinns auf der Spur
Chemiker der ETH Zürich und der TU München geben Prionenforschern ein neues Werkzeug in die Hand, mit dem sie die Rolle von speziellen Ankermolekülen bestimmen können. Denn diese komplizierten Verbindungen stehen im Verdacht, BSE oder die Creutzfeldt-Jacob-Krankheit zu begünstigen.
Der Rinderwahnsinn war vor Jahren in aller Munde und Medienthema Nummer eins. Seit einiger Zeit ist es ruhig geworden um die von Prionenproteinen ausgelöste Krankheit. Der Fall ist jedoch längst nicht abgeschlossen. Erst im September berichteten Wissenschaftler von einer neuen Form von BSE, der Krankheit BASE, die zwar seit 2003 bekannt ist. Und erst kürzlich fanden die Forscher heraus, dass sich das BASE-erregende Prion auf Primaten und möglicherweise auf den Menschen übertragen lässt, und die Krankheit schreitet noch rascher fort als BSE.
Ungeklärter Infektionsbeginn
Noch sind einige Geheimnisse der Prionenerkrankungen nicht gelüftet. So ist nicht klar, weshalb das Prion, ein relativ einfach aufgebautes Protein, plötzlich seine Struktur ändert und dadurch den Trägerorganismus, etwa Kuh, Schaf, Mensch, krank macht.
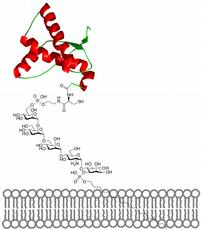
Die Forscher verdächtigen die so genannten Glycosylphosphatidylinositole, kurz GPI genannte Moleküle, die an Prionproteinen gebunden sind. GPI bestehen aus Zucker- und Fettresten und verankern Prionen in der Zelloberfläche. Diese GPI-Verankerung von Prionen ist möglicherweise für die Infektion verantwortlich, bevor das Prion seine Struktur von harmlos zu schädlich ändert und weitere Prionen dazu bringt, sich so zu falten, dass sie krankmachen.
Nicht isolierbares Gebilde
Bisher ist es allerdings nicht gelungen, diese komplizierten, verankerten Prionen vollständig aus natürlichen Systemen zu isolieren, und die Forschung hat sich darauf beschränken müssen, die ungewöhnlichen Krankheitserreger ohne Anker auf Struktur, Funktion, Stabilität und Faltung zu untersuchen. Das wiederum bedeutet, dass die genaue Funktion des GPI-Ankers nicht direkt bestimmt werden konnte. Und „nackte“ Prionen schaffen es nicht, in die Zelle einzudringen, um die Infektion zu starten.
Diese Lücke füllt nun ein deutsch-schweizerisches Forschungsteam um Peter Seeberger, ETH-Professor für organische Chemie, und Christian Becker, Professor am Labor für Proteinchemie an der TU München. Ihnen ist es erstmals gelungen, den kompliziert aufgebauten Molekülkomplex im Labor künstlich nachzubauen. Seebergers Gruppe synthetisierte den GPI-Anker, Beckers Gruppe das Prion. Danach wurden die beiden Stoffe zusammengefügt und zu einem Ganzen vervollständigt. „Die Synthese des GPI-Ankers ist für die Chemie ein Meilenstein. Bis anhin ist es nicht gelungen, solch komplizierte, verankerte Moleküle künstlich herzustellen“, betont Seeberger.
Werkzeug geliefert
Erste Tests zeigen den Forschern, dass sie das „richtige“
Ding geschafften haben. Das Kunstprion und sein GPI können sich in Membranen
verankern. Für die Prionenforscher bedeutet dieser Durchbruch, dass sie die
Rolle des GPI-Ankers und des daran angehängten Prions nun endlich genauer
untersuchen können um festzustellen, ob das GPI tatsächlich Einfluss hat auf
die Faltung des Prions und die daraus resultierende krankmachenden
Eigenschaften. „Das wird die Arbeit der Prionenforscher um Professor Adriano Aguzzi
vom Unispital Zürich sein, denen wir mit unseren Molekülen das entsprechende Werkzeug
in die Hand geben“, so ETH-Professor Seeberger.
Literaturhinweis
Becker CFW, Liu X, Olschewski D, Castelli R, Seidel R, Seeberger PH: Semisynthesis of a Glycosylphosphatidylinositol-Anchored Prion Protein, Angewandte Chemie, Volume 47, Issue 43, Pages 8215-8219; doi:10.1002/anie.200802161








LESERKOMMENTARE