Bakterien mit «Kraft-Sensoren»
Stehen Bindegewebsfasern unter Spannung, binden Bakterien weniger gut daran. Werden die Fasern jedoch durch einen Schnitt durchtrennt und erschlaffen, erkennen dies die Adhäsionsmoleküle der Bakterien, haften sich an und können so Infektionen verursachen.
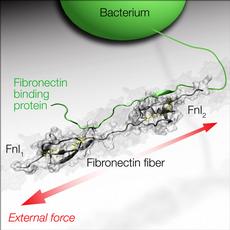
Im lebenden Organismus ziehen Zellen ständig an den Matrixfibrillen, die sie umgeben - beispielsweise an den Proteinfasern Fibronektin. In einer intakten Umgebung des Bindegewebes wird Fibronektin dadurch ständig gestreckt. Schneidet man sich oder verursachen enzymatische Prozesse bei einer Entzündung im Gewebe eine Art Schnitt, fällt der Zug auf die Fibronektin-Fasern weg. Gelöst im Blut spielt Fibronektin dann eine wichtige Rolle bei der Wundheilung. Es wird von den Zellen in ein fibrilläres Netzwerk verflochten und leitet den ersten Schritt ein, die Wunde zu reparieren. Erst wenn der Reparaturprozess des Gewebes einsetzt, baut die Faserspannung wieder auf – sichtbar an den gekräuselten Wundrändern während der Heilung.
Bindungsstellen, aufgereiht wie Perlen
Fibronektin ähnelt einer Kette mit etwa 50 «Perlen», wobei viele dieser «Perlen» eine Bindungsstelle für im Bindegewebe wichtige Moleküle exponieren; etwa für Kollagene oder Zellen. Am Ende des Moleküls gibt es fünf «Perlen», an die auch Bakterien über bestimmte Segmente der langen Proteinfäden, mit denen Bakterienoberflächen dekoriert sind, an eine der «Perlen» binden können. Bakterien, wie etwa Staphylococcus aureus, der gefürchtete Krankenhauskeim und typische Erreger bei Abszessen und Furunkeln, können Fibronektin sogar spezifisch erkennen und so Wunden infizieren.
Die Forschergruppe von Viola Vogel, Professorin für Biologisch-Orientierte Materialwissenschaften an der ETH Zürich, hat nun untersucht, wie sich die ständigen Zugkräfte der Zellen auf Bindegewebsfasern auf die Interaktion zwischen Bakterien und Fibronektin auswirken. Die Wissenschaftler simulierten hierfür mit einem Supercomputer, wie sich die Struktur des Komplexes zwischen Fibronektin und dem bakteriellen Eiweissmolekül verändert, wenn an Fibronektin gezogen wird. Vogels Doktorand Samuel Hertig wollte damit prüfen, ob die Segmente der Bakterien beim Ankoppeln wie eine Art Klammer wirken und dadurch das Strecken von Fibronektin verhindern. Doch die Simulation zeigt ein völlig anderes Bild: Während im Anfangsstadium das Bakterium an zwei Stellen an das Fibronektin bindet, verliert es, sobald Zug auf das Molekül wirkt, an einer Stelle den Kontakt zum Fibronektin-Molekül, und die Bindung wird zerstört. «Die Modelle liefern uns ein hochaufgelöstes Bild davon, wie die Bindung reisst. Mikroskopisch würden wir das nie sehen», sagt Vogel. Sie zeigen aber auch, dass Bakterien weniger gut an gestreckte Fibronektin-Fasern binden. Die Wissenschaftler schliessen daraus, dass bakterielle Adhäsionsmoleküle, mit denen Bakterien an Gewebefasern anhaften können, in der Lage sind, den physikalischen Zustand der Fibronektin-Moleküle zu erkennen. Ihre Studie wurde heute im E-Journal «Nature Communications» publiziert.
Im Labor verifiziert
Viola Vogel erforscht, wie mechanische Faktoren die bekannten klassischen Gleichgewichtsstrukturen in der Biologie verändern. Etwa wie Strecken und Ziehen an Molekülen deren Funktionsweise schaltet. «Da es bis jetzt jedoch keine experimentellen Werkzeuge gibt, mit denen wir Strukturen, die sich nicht im Gleichgewicht befinden, bestimmen können, müssen wir diese mit Hilfe von Supercomputern berechnen», sagt Vogel. Die neuste Entdeckung ihres Teams ist ein eindrückliches Beispiel für den Erfolg und Nutzen rechnergestützter Wissenschaften. Aus der Simulation leiteten die Forscher ihre Theorie ab, die letztlich im Experiment verifiziert werden konnte.
Dies gelang mit einer Methode, welche die Wissenschaftlerin mit ihrem Team vor einigen Jahren entwickelte, und die den Streckungsgrad des Fibronektins über Farben sichtbar macht. Da es jedoch schwierig ist, in Zellkulturen Bindungsstudien durchzuführen, «bauten» die Forscher eine spezielle Versuchsanordnung, bei der sie Fibronektin-Fasern extrahierten und diese auf streckbare Substrate aufbrachten. Die Doktorandin Mamta Chabria konnte damit zeigen, dass bei gestreckter Fibronektin-Faser in Gegenwart der bakteriellen Adhäsionsmoleküle derselbe Vorgang wie im Modell abläuft.
Da bekannt ist, dass Heparin, das zur Thrombosen-Prophylaxe genutzt wird, an den selben Stellen an Fibronektin anbindet wie die Bakterien, untersuchten die Wissenschaftler zudem, ob grosse Mengen Heparin ein Schutz gegen Infektionen darstellt. «Wir konnten sehen, dass Heparin die Anbindung von bakteriellen Adhäsionsmolekülen an Fibronektin zwar reduziert, aber die Bakterien reagieren trotzdem auf mechanische Prozesse», sagt Vogel.
Die Erkenntnisse, dass das winzige Bakterium den physikalischen Zustand eines Proteins erkennen kann und dass der Streckvorgang die Adhäsion verändert, sind essentiell im Verständnis biochemischer Prozesse. Es handelt sich dabei um eine von vielen – noch unentdeckten – Wechselwirkungen. Hinzu kommt, dass nur kleine Elemente des gesamten Adhäsionsbereichs untersucht wurden. «Deshalb kann man im Moment nicht sagen, was die Entdeckung langfristig für Folgen – etwa auf Therapien von Infektionskrankheiten – haben wird», betont Vogel. Bereits ist neue Rechenzeit beim Nationalen Hochleistungsrechenzentrum CSCS in Manno beantragt, an dem die ETH-Professorin ihre Modellierungen durchführt. Sie möchte weitere Fragen klären, etwa warum unterschiedliche Bakterien, die an Fibronektin anbinden, sich in der Anzahl ihrer Adhäsionsmoleküle unterscheiden.
Literaturhinweis
Chabria M, Hertig S, Smith LM & Vogel V: Stretching fibronectin fibres disrupts binding of bacterial adhesins by physically destroying an epitope, Nature Communications (2010). doi:10.1038/ncomms1135








LESERKOMMENTARE