Umgenutzte Bakterien
Forscher haben einen Weg gefunden, mit Zuckern verknüpfte Proteine halb biologisch, halb chemisch herzustellen. Damit ist es möglich, grosse Mengen unterschiedlicher Glykoproteine für verschiedene medizinische und biologische Studien zusammenzubauen.
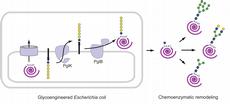
Wenn das Darmbakterium E.coli und der Durchfall-Erreger Campylobacter zusammenarbeiten, muss nicht eine Erkrankung daraus resultieren. Und wenn darüber hinaus Biologen und Chemiker zusammenspannen, um das Produkt dieser bakteriellen Zusammenarbeit zu nutzen, dann entsteht eine neuartige Technologie mit möglichen pharmazeutischen Anwendungen. So haben ETH-Doktorand Flavio Schwarz aus der Gruppe von Professor Markus Aebi vom Institut für Mikrobiologie sowie Forscher von der University of Maryland eine neue Methode zur Herstellung von Zucker-Proteinen entwickelt.
Neues Werkzeug
Denn E.coli ist eine biochemische Werkstatt, die zur Herstellung von Proteinen, auch industriell, genutzt werden kann. In dieser Werkstatt fehlen jedoch viele der Werkzeuge, die eine Zelle benötigt, um Proteine nachträglich mit Zuckermolekülen verändern zu können. Forscher um Markus Aebi haben aber kürzlich entdeckt, dass Campylobacter etwas kann, was nur Eukaryoten wie menschliche Zellen können: Er kann Proteinen nach deren Synthese Zuckermoleküle anhängen, also Glykoproteine herstellen.
In ihrem neuen, so eben in «Nature Chemical Biology» online vorgestellten Verfahren haben die Forscher Gene des Glykosylierungswerkzeugs von Campylobacter in E.coli eingebaut und so verändert, dass nun Glykoproteine auch in der Werkstatt dieses Bakteriums produziert werden. Diese bakteriellen Glykoproteine sind in einem wesentlichen Teil wie menschliche aufgebaut. In einem zweiten Schritt, ausserhalb der Bakterienzelle, entfernten die Biologen die bakteriellen Teile des Zuckers von den Glykoproteinen und ersetzten diesen mit chemisch synthetisierten Zuckermolekülen von unterschiedlicher Grösse und Struktur, wie sie auch in menschlichen Zellen vorkommen.
Glykoproteine definieren Blutgruppe
Damit lassen sich nun quasi am Fliessband unterschiedliche Glykoproteine in grosser Anzahl fabrizieren. Dies hilft der Forschung, Struktur und Funktion von einzelnen Glykoproteinen gezielter zu untersuchen. Will man zum Beispiel Wirt-Pathogen-Wechselwirkungen untersuchen, braucht man reine Proben eines bestimmten Glykoproteins. Natürliche Systeme liefern der Forschung lediglich eine hochkomplexe Mischung von solchen Stoffen.
Glykoproteine spielen in der Biologie eine überragend wichtige Rolle. So sind sie an der Oberfläche und ausserhalb von Zellen häufiger anzutreffen als «normale» Proteine. Sie sind an zahlreichen zellulären Vorgängen beteiligt, etwa an Kontakten und der Kommunikation zwischen Zellen. Sie sind in Schleim enthalten und die unterschiedliche Glykosylierung von Blutproteinen ist ausschlaggebend für die Blutgruppe.
Konzept geht auf
Die neue Methodik ist auch für die Krebsforschung vielversprechend, da Glykoproteine mit neuartigen Eigenschaften für die Therapie hergestellt werden können. Sie können zum Beispiel so verändert werden, so dass sie länger im Blutstrom verweilen, ehe sie abgebaut werden.
«Bis jetzt haben wir erst einmal beweisen können, dass unser Konzept funktioniert. Die Zukunft wird mögliche praktische Anwendungen aufzeigen », sagt der Doktorand Flavio Schwarz an der Life Science Zurich Graduate School. Das neue Verfahren habe sich als «Nebenprodukt» seiner Dissertation ergeben – was einmal mehr beweist, dass die Grundlagenforschung auch zu anwendungsnahen Resultate führen kann. Es braucht nur findige Köpfe wie Flavio Schwarz, welche dies erkennen.
Literaturhinweis
Schwarz F et al. A combined method for producing homogenous glycoproteins with eukaryotic N-glycosylation, Nature Chemical Biology. 2010. Published online 28 Feb. Doi: 10.1038/nchembio.314








LESERKOMMENTARE