Fehlerfreudiges Zusammenspiel
Zwei Reparatursysteme zusammen könnten viele Fehler erzeugen. Diesen Befund stützt eine neue Zürcher Studie. Sie zeigt, dass ein DNA-Reparaturmechanismus, die Fehlpaarungs-Reparatur, auch aktiviert wird, wenn sie mit einem anderen Reparatur-Mechanismus, der Basen-Exzisions-Reparatur, kollidiert. Auf einem Substrat, das der DNA des Immunglobulin-Lokus – einem Abschnitt des Genoms, der für Antikörper kodiert - nachempfunden ist, konnte dieses Zusammenspiel gezeigt werden. Dieses könnte zu der bekannten, in diesem Fall erwünschten, Hypermutation führen.
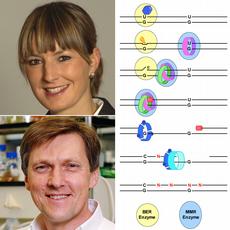
Mutationen sind in Lebewesen generell unerwünscht; in einzelligen Organismen führen sie häufig zum Tod des Organismus, in höheren mehrzelligen Lebewesen besteht hingegen die Gefahr der Entartung einer einzelnen Zelle, aus der sich Krebs entwickeln kann. Entsprechend haben sich mehrere Reparatursysteme entwickelt: Die Fehlpaarungs-Reparatur (engl: Mismatch Repair, MMR) führt zum Abbau von fehlerhaften DNA-Strängen, sofern diese eine Basen-Fehlpaarung als auch einen Bruch oder eine Lücke enthalten. Die Basen-Exzisions-Reparatur (engl: Base Excision Repair, BER) wird aktiv, wenn ein DNA-Strang eine modifizierte Base enthält (beispielsweise Uracil statt Cytidin). Beide Prozesse tragen dazu bei, dass die DNA-Integrität gewahrt bleibt.
In gewissen Situationen sind aber Fehler, beziehungsweise ist Vielfalt durch Mutation erwünscht. So bei den Antikörpern, die möglichst variabel sein sollten, um optimal die Antigene erkennen zu können. In den entsprechenden Antigen-erkennenden Regionen kommt es darum zur sogenannten somatischen Hypermutation. Die Forschungsgruppe von Josef Jiricny, Bonizzi-Theler Professor für Funktionelle Genomik der ETH Zürich und ordentlicher Professor der Universität Zürich, konnte nun in einer Studie zeigen, dass die beiden erwähnten Reparaturmechanismen in bestimmten DNA-Substraten zusammenspielen. Daraus lässt sich ein neuer Mechanismus der somatischen Hypermutation ableiten. Die Studie erschien kürzlich in der Fachzeitschrift PNAS.
Suche nach Fehlerursache
Aus früheren Studien war bereits bekannt, dass am Immunglobulin-Lokus ein Enzym viele Cytidin-Basen in Uracil-Basen umwandelt und somit die somatische Hypermutation einleitet. Interessanterweise finden sich Mutationen nicht nur am Cytidin, sondern auch an den benachbarten Basenpaaren Adenin/Thymidin und dies mit gleicher Häufigkeit. Dies legte eine Rolle der Fehlpaarungs-Reparatur in Kombination mit einer fehlerhaften Polymerase (Polymerase-ŋ) nahe. Diese Polymerase füllt dabei die durch die MMR erzeugte Lücke im DNA-Strang so, dass der Doppelstrang an Stellen mit dem ursprünglichen Basenpaar A/T Fehler enthält.
Diese Situation brachte Jiricny auf die vordergründig paradoxe Idee, dass vielleicht die beiden Reparaturmechanismen BER mit MMR im Zusammenspiel diese Vielfalt erzeugen. BER sollte aufgrund der vielen falschen Uracil-Basen aktiviert werden. MMR, ebenfalls aktiviert durch die Uracil/Guanidin Fehlpaarung, könnte wiederum die Lücke während der BER nutzen, um einen DNA-Strang abzubauen. Erfolgt danach die Synthese des DNA-Strangs durch die Polymerase-ŋ kommt es zum fehlerhaften Einbau von Basen und somit zur somatischen Hypermutation. (vereinfachtes Model siehe Abbildung)
Reparatur beobachten
Um das zu demonstrieren, konstruierten die Zürcher Forscher ein ringförmiges DNA-Substrat, das der hypervariablen Region der Antikörper nachempfunden war. Indem sie gezielt Uracil/Guanidin Fehlpaarungen einbauten, konnten sie überprüfen, wie weit die verschiedenen Reparaturmechanismen aktiv werden. Der Trick dabei war, dass die Wissenschaftler die Fehler in eine DNA-Schnittstelle einbauten und diese somit zerstörten. Erst nach einer erfolgten Reparatur ist diese Schnittstelle wieder zugänglich, sodass bei einem nachfolgenden DNA-Verdau mehr DNA-Fragmente entstehen.
Eine Analyse der verschiedensten Szenarien ergab, dass die MMR in einen laufenden BER Reparaturprozess eingreifen kann. Die MMR bedient sich eines Strangbruches, während BER noch läuft, und nutzt diesen zum Generieren einer grösseren Lücke. So kann plausibel erklärt werden, wie das Zusammenspiel der Reparaturmechanismen in der speziellen Situation des Immunglobulin-Lokus zu einer erhöhten Mutationsrate führen könnte.
Die Entstehung von Fehlern in den hypervariablen
Regionen der Antikörper direkt nachzuweisen, ist eines der nächsten Projekte
von Josef Jiricny. Er ist aber jetzt bereits begeistert davon, dass
möglicherweise die Natur in genialer Weise Reparaturmechanismen so gekoppelt
hat, dass sie in Kombination das Gegenteil ihrer ursprünglichen Aufgabe
bewirken.
Literaturhinweis:
Schanz S, Castor D, Fischer F & Jiricny J: Interference of mismatch and base excision repair during the processing of adjacent U/G mispairs may play a key role in somatic hypermutation. PNAS 2009 doi:10.1073/pnas.0901726106








LESERKOMMENTARE