Neustart für Hefezellen
ETH-Forscherinnen und Forscher um Professor Yves Barral haben einen fundamentalen Mechanismus entdeckt, der erklärt, weshalb eine alte Hefezelle eine Neue abschnüren kann, deren Alter auf Null zurückgesetzt wird. Das Geheimnis ist eine sehr effektive Barriere, die den Austausch von Alterungsfaktoren verhindert.
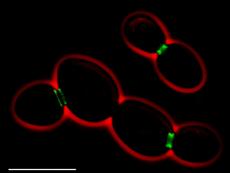
Hefezellen können sich durch Knospung vermehren, indem eine
Mutterzelle eine kleinere Tochterzelle abschnürt. Mutter und Tochter sehen
während des Vorgangs zeitweise aus wie eine dreidimensionale Acht mit einem
charakteristischen Flaschenhals respektive einem „Knospungshals“. Dabei
entstehen zwei genetisch identische Zellen. Das Erstaunliche daran ist, dass
die Tochterzelle nicht das Alter der Mutterzelle hat. Die innere Uhr der
Tochter wird bei der Knospung auf Null zurückgestellt. Weshalb dem so ist, hat
die Forschungsgruppe von Yves Barral, Professor für Biochemie, in der neuen
Ausgabe „Nature“ dargestellt. Die Biologinnen und Biologen haben damit einen
fundamentalen molekularen Mechanismus geklärt, der über das Hefemodell
hinausreichen könnte.
Altlasten kommen nicht durch
Die Forscher haben beobachtet, dass sich Porenproteine der Zellkernhülle der Mutterzelle so lange frei darauf bewegen können, bis der Flaschenhals zwischen dem Zellkern der Mutter und dem entstehenden Tochterkern gebildet wird. Bei der Einschnürungsstelle entsteht eine so genannte Diffusionsbarriere, die verhindert, dass die Proteine weiterwandern. Auch Altersfaktoren, die sich im Leben einer Mutterzelle im Zellkern anhäufen, können die Schranke nicht passieren, weil sie an die Kernporen gebunden und so in der Mutterzelle verankert sind. Zu diesen Altersmerkmalen gehören unter anderem ringförmige DNS-Stücke. Die neue Zelle ist deshalb – molekular gesprochen – jung. Die Tochterzelle muss zudem die Proteine zur Bildung von Kernporen neu synthetisieren.
Die Bildung respektive Wirksamkeit der Diffusionsbarriere wiederum hängt von den Proteinen Septin und Bud6 ab, letzteres sitzt an diesem Flaschenhals und ist an dessen Bildung und Aufrechterhaltung beteiligt. Fehlt Bud6 in entsprechenden Hefemutanten, bildet sich keine Diffusionsbarriere, Porenproteine wie auch die Alterfaktoren gehen zur Tochterzelle – und machen sie gleich alt wie die Mutter.
Keine Lebensverlängerung
Die Schranke ist jedoch nicht dafür da, das Leben der Zellen zu verlängern. Sie sorgt dafür, dass die jungen Zellen nicht „vorbelastet“ ins Leben starten und sich besser an allenfalls veränderte Umweltbedingungen anpassen können als ihre Mutanten-Artgenossen. In einer Population mit Mutanten steigt die durchschnittliche Lebenserwartung sogar, weil die Mutterzelle ihren Altersballast teilweise an die Tochter abgibt, sich dadurch selbst ein wenig verjüngt.
Woraus die Barriere besteht, ist noch unklar. Barral vermutet, dass es sich um eine Doppellipidschicht handelt, die dicker ist als eine normale. „Lipide in lebenden Zellen zu untersuchen, ist jedoch sehr schwierig“, gibt er zu verstehen. Es fehle noch an der Methode, unter anderem an einer Anfärbemethode, um sie sichtbar zu machen.
Philosophie
Die Resultate dieser Studie seien der „Revolution in der Lichtmikroskopie“ zu verdanken, so der Biochemie-Professor. Dadurch sei es gelungen, spezifische Proteine in einzelnen Zellen in Echtzeit zu beobachten. Die Untersuchungen wurden im Lichtmikroskopie-Zentrum der ETH Zürich gemacht, einer Einrichtung, die von mehreren Professuren aufgebaut und getragen wird.
Für Barral steht ausser Zweifel, dass sie mit ihrer Arbeit
einem Geheimnis des Alterns nicht nur von Zellen sondern von ganzen Organismen
auf die Spur gekommen sind. Zwar haben sie „nur“ Hefen untersucht, doch dieses
Lebewesen ist Zelle und Organismus in einem. Asymmetrische Zellteilungen lassen
sich auch bei Stammzellen des Menschen beobachten. Auch dieser Zelltyp stellt
das Alter des „Nachwuchses“ nach der Zellteilung auf Null zurück. „Die
Ergebnisse sind deshalb viel breiter zu verstehen“, betont der Biochemiker. So könne man sich fragen,
weshalb ein Baby nicht das gleiche Alter habe wie seine Erzeuger. „Es ist
besonders befriedigend, wenn Forschung solche zentrale Themen berührt, und
damit philosophische Fragen aufgreift“, sagt Barral.
Literaturhinweis
Shcheprova Z, Baldi S, Buvelot frei S, Gonnet G & Barral Y. A mechanism for asymmetric segregation of age during yeast budding. 2008, Nature, Vol. 454, no. 7205, doi: 10.1038/nature07212.








LESERKOMMENTARE